IPTG (isopropyl-β-D-thiogalactoside) adalah analog dari substrat β-galactosidase, yang sangat dapat diinduksi.Di bawah induksi IPTG, penginduksi dapat membentuk kompleks dengan protein represor, sehingga konformasi protein represor diubah, sehingga tidak dapat digabungkan dengan gen target, dan gen target diekspresikan secara efisien.Jadi bagaimana seharusnya konsentrasi IPTG ditentukan selama percobaan?Apakah semakin besar semakin baik?
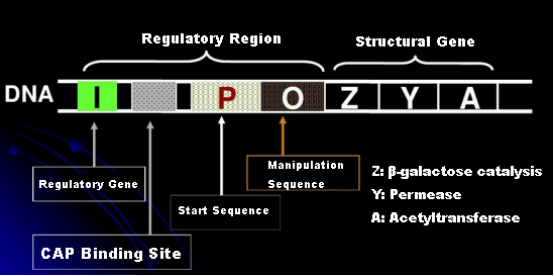
Pertama, mari kita pahami prinsip induksi IPTG: operon (elemen) laktosa E. coli mengandung tiga gen struktural, Z, Y, dan A, yang masing-masing mengkodekan β-galactosidase, permease, dan acetyltransferase.lacZ menghidrolisis laktosa menjadi glukosa dan galaktosa, atau menjadi alo-laktosa;lacY memungkinkan laktosa di lingkungan melewati membran sel dan masuk ke dalam sel;lacA mentransfer gugus asetil dari asetil-KoA ke β-galactoside, yang melibatkan penghilangan efek Toksik.Selain itu, terdapat sekuen operasi O, sekuens awal P dan gen pengatur I. Kode gen I merupakan protein represor yang dapat berikatan dengan posisi O dari sekuen operator, sehingga operon (meta) direpresi dan matikan.Ada juga situs pengikatan untuk situs pengikatan protein-CAP aktivator gen katabolik di bagian hulu dari urutan inisiasi P. Urutan P, urutan O dan situs pengikatan CAP bersama-sama merupakan wilayah pengatur operon lac.Gen penyandi dari ketiga enzim diatur oleh wilayah pengatur yang sama untuk mencapai ekspresi produk gen yang terkoordinasi.
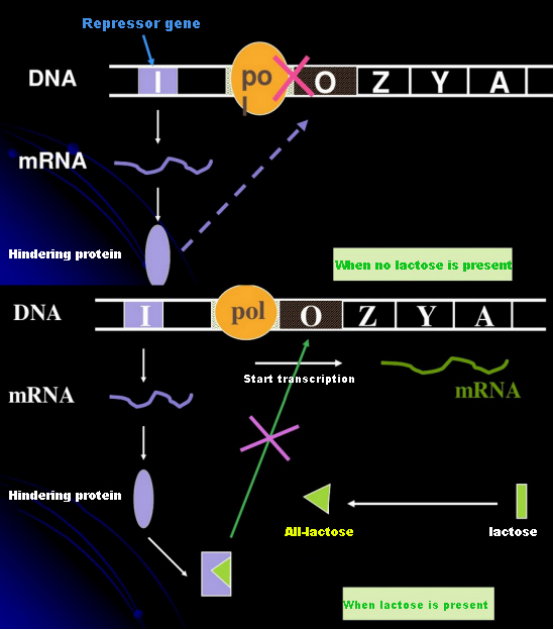
Dengan tidak adanya laktosa, lac operon (meta) berada dalam keadaan tertekan.Pada saat ini, represor lac yang diekspresikan oleh urutan I di bawah kendali urutan promotor PI berikatan dengan urutan O, yang mencegah pengikatan RNA polimerase ke urutan P dan menghambat inisiasi transkripsi;ketika laktosa hadir, lac operon (meta) dapat diinduksi. Dalam sistem operon (meta) ini, penginduksi sebenarnya bukanlah laktosa itu sendiri.Laktosa masuk ke dalam sel dan dikatalisis oleh β-galaktosidase untuk diubah menjadi allolaktosa.Yang terakhir, sebagai molekul penginduksi, berikatan dengan protein penekan dan mengubah konformasi protein, yang menyebabkan disosiasi protein penekan dari urutan O dan transkripsi.Isopropylthiogalactoside (IPTG) memiliki efek yang sama dengan allolaktosa.Ini adalah penginduksi yang sangat kuat, yang tidak dimetabolisme oleh bakteri dan sangat stabil, sehingga banyak digunakan di laboratorium.
Bagaimana cara menentukan konsentrasi IPTG yang optimal?Ambil E. coli sebagai contoh.
Strain hasil rekayasa genetika E. coli BL21 yang mengandung pGEX rekombinan positif (CGRP/msCT) diinokulasi ke dalam media cair LB yang mengandung 50μg·mL-1 Amp, dan dikultur semalaman pada suhu 37°C.Kultur di atas diinokulasi ke dalam 10 botol media cair LB segar 50mL yang mengandung 50μg·mL-1 Amp dengan perbandingan 1:100 untuk kultur ekspansi, dan ketika nilai OD600 adalah 0,6~0,8, IPTG ditambahkan ke konsentrasi akhir.Ini adalah 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0mmol·L-1.Setelah induksi pada suhu yang sama dan waktu yang sama, 1 mL larutan bakteri diambil darinya, dan sel bakteri dikumpulkan dengan sentrifugasi dan dikenai SDS-PAGE untuk menganalisis pengaruh konsentrasi IPTG yang berbeda pada ekspresi protein, dan kemudian pilih konsentrasi IPTG dengan ekspresi protein terbesar.
Setelah dilakukan percobaan, akan diketahui bahwa konsentrasi IPTG tidak sebesar mungkin.Hal ini karena IPTG memiliki toksisitas tertentu terhadap bakteri.Melebihi konsentrasi juga akan membunuh sel;dan secara umum, kami berharap bahwa semakin banyak protein terlarut yang diekspresikan dalam sel, semakin baik, tetapi dalam banyak kasus ketika konsentrasi IPTG terlalu tinggi, sejumlah besar inklusi akan terbentuk.Tubuh, tetapi jumlah protein larut menurun.Oleh karena itu, konsentrasi IPTG yang paling sesuai seringkali bukan semakin besar semakin baik, tetapi semakin rendah konsentrasinya.
Tujuan induksi dan kultivasi galur hasil rekayasa genetika adalah untuk meningkatkan hasil protein target dan mengurangi biaya.Ekspresi gen target tidak hanya dipengaruhi oleh faktor strain itu sendiri dan ekspresi plasmid, tetapi juga oleh kondisi eksternal lainnya, seperti konsentrasi penginduksi, suhu induksi, dan waktu induksi.Oleh karena itu, secara umum, sebelum protein yang tidak diketahui diekspresikan dan dimurnikan, yang terbaik adalah mempelajari waktu induksi, suhu dan konsentrasi IPTG untuk memilih kondisi yang sesuai dan mendapatkan hasil percobaan yang terbaik.
Waktu posting: Des-31-2021

