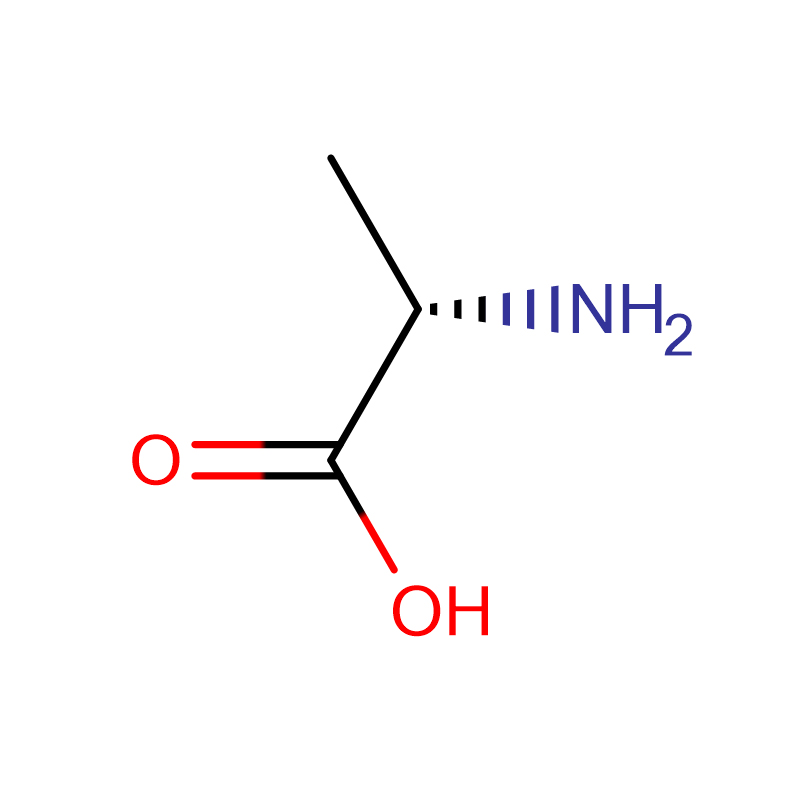
L-Alanine CAS:56-41-7 99% Serbuk kristal putih
| Nomor katalog | XD90326 |
| Nama Produk | D-Alanin |
| CAS | 338-69-2 |
| Formula molekul | C3H7NO2 |
| Berat molekul | 89.09 |
| Detail Penyimpanan | Sekelilingnya |
| Kode Tarif Harmonisasi | 29224985 |
Spesifikasi produk
| Penampilan | Bubuk kristal putih |
| Pengujian kadar logam | 98,5 - 101,5% |
| Rotasi spesifik | +13,7 hingga +15,1 |
| Logam berat | <0,0015% |
| pH | 5,5 - 7 |
| SO4 | <0,03% |
| Kerugian pada Pengeringan | <0,2% |
| Besi | <0,003% |
| Residu saat pembakaran | <0,15% |
| Ukuran partikel | 200um |
| Cl | <0,05% |
| Tingkat polutan organik yang persisten | Tidak ada polutan |
γ-Glutamyltranspeptidases (γ-GTs) membelah ikatan γ-glutamyl amida glutathione dan mentransfer gugus γ-glutamyl yang dilepaskan ke air (hidrolisis) atau asam amino akseptor (transpeptidasi).Enzim yang ada di mana-mana ini memainkan peran kunci dalam biosintesis dan degradasi glutathione, dan dalam detoksifikasi xenobiotik.Di sini kami melaporkan struktur kristal resolusi 3Å dari Bacillus licheniformis γ-GT (BlGT) dan kompleksnya dengan l-Glu.Struktur sinar-X mengkonfirmasi bahwa BlGT milik superfamili nukleofilik hidrolase N-terminal dan mengungkapkan bahwa protein tersebut memiliki celah situs aktif terbuka yang serupa dengan yang dilaporkan untuk enzim homolog dari Bacillus subtilis, tetapi berbeda dari yang diamati untuk γ-GT manusia dan untuk γ-GT dari mikroorganisme lain.Data menunjukkan bahwa pengikatan l-Glu menginduksi penataan ulang ujung C-terminal subunit besar BlGT dan memungkinkan identifikasi sekelompok residu asam yang berpotensi terlibat dalam pengenalan ion logam.Peran residu ini pada stabilitas konformasi BlGT telah dipelajari dengan mengkarakterisasi proses otomatis, aktivitas enzimatik, denaturasi kimia dan termal dari empat mutan tunggal Ala baru.Hasil penelitian menunjukkan bahwa penggantian Asp568 dengan Ala mempengaruhi proses autoproses dan stabilitas struktur protein.