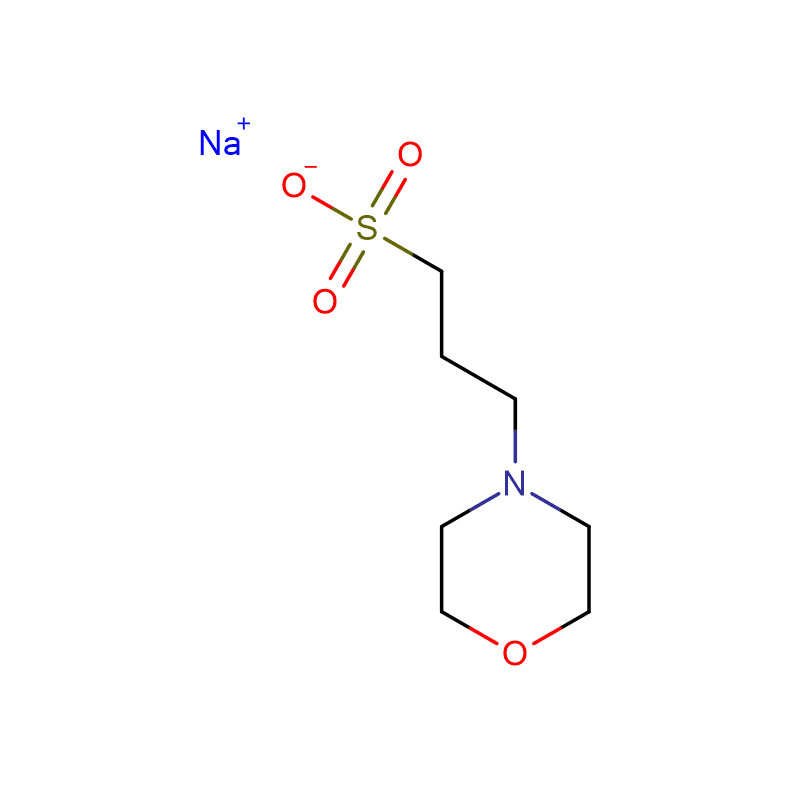
HEPBS Cas:161308-36-7 N- (2- Hydroxyethyl) piperazine- N'- (4- butanesulfonic acid) Serbuk kristal putih 99%
| Nomor katalog | XD90100 |
| Nama Produk | HEPBS |
| CAS | 161308-36-7 |
| Formula molekul | C10H22N2O4S |
| Berat molekul | 266.36 |
| Detail Penyimpanan | Sekelilingnya |
| Kode Tarif Harmonisasi | 2933599090 |
Spesifikasi produk
| Penampilan | Bubuk kristal putih |
| Assay | ≥ 99% |
| Suhu Penyimpanan | Simpan di RT |
| Titik lebur | 211-216°C |
| Koefisien keasaman (pKa) | 8,3 (pada 25 ℃) |
Kami memahami pentingnya melindungi integritas biomolekul dan reagen Anda dengan sistem penyangga yang tepat.Buffer biologis kami memberikan stabilitas larutan dan kontrol pH tanpa mengganggu proses biologis, serta memasok garam dan nutrisi penting untuk sel dan jaringan.Sistem penyangga canggih kami dapat memberi Anda stabilitas fenomenal dalam kultur sel, reaksi berantai polimerase (PCR), penyaringan obat, bioproses, pemurnian, dan aplikasi formulasi akhir.Semua produk kami dapat diskalakan dari penelitian awal hingga aplikasi komersial dalam berbagai tingkat buffer.Kami menawarkan berbagai konfigurasi pengemasan, pencampuran khusus, dan bahkan formulasi cair.
Kami juga menyediakan pilihan biokimia berkualitas tinggi yang komprehensif dalam berbagai tingkatan praktis dan dalam berbagai pilihan pengemasan yang inovatif dan mudah digunakan.Selain produk siap pakai, kami menawarkan pembuatan, pencampuran, dan pengemasan reagen khusus untuk memenuhi kebutuhan Anda.
Prinsip kerja dan nilai pH larutan buffer Ketika sejumlah asam dan basa ditambahkan ke beberapa larutan, itu memiliki efek menghambat perubahan pH larutan, yang disebut efek buffering.Larutan seperti itu disebut larutan penyangga.Larutan campuran asam lemah dan garamnya (seperti HAc dan NaAc), dan larutan campuran basa lemah dan garamnya (seperti NH3·H2O dan NH4Cl) adalah larutan penyangga.Efek buffer dari larutan buffer yang terdiri dari asam lemah HA dan garamnya NaA pada asam disebabkan oleh adanya alkali A- dalam jumlah yang cukup dalam larutan.Ketika sejumlah asam kuat ditambahkan ke dalam larutan ini, ion H pada dasarnya dikonsumsi oleh ion A-: sehingga pH larutan hampir tidak berubah;ketika sejumlah basa kuat ditambahkan, asam lemah HA yang ada dalam larutan mengkonsumsi ion OH- menghambat perubahan pH.



![TAPS-NA Cas:91000-53-2 Cairan 99% N-[Tris(hidroksimetil)metil]-3-asam aminopropanasulfonat garam natrium](http://cdn.globalso.com/xdbiochems/91000-53-2.jpg)