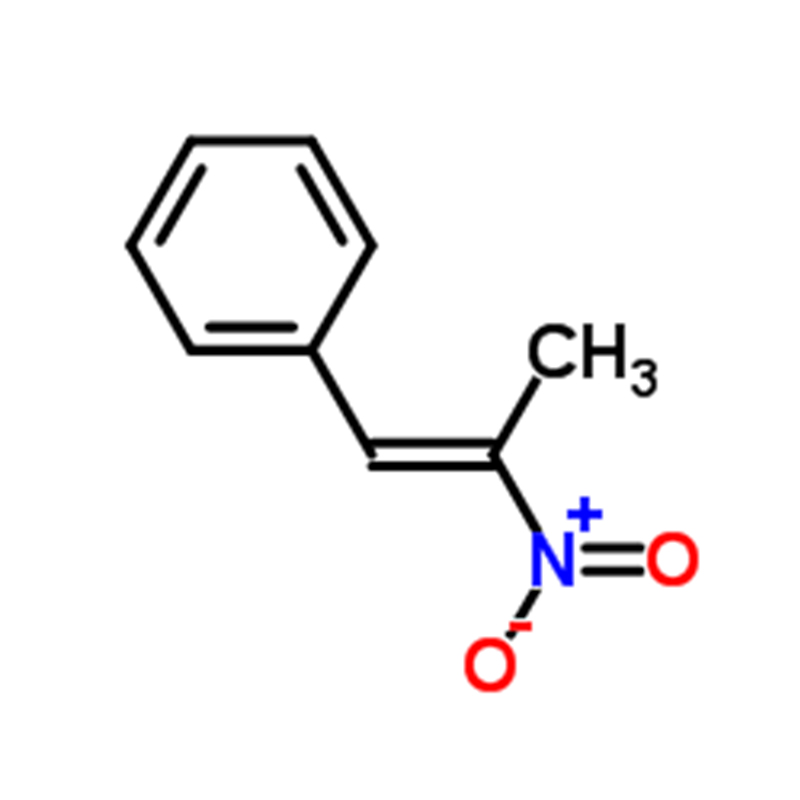
Dimethyl yellow CAS: 60-11-7 Yellow to Orange to brown powder
| Nomor katalog | XD90467 |
| Nama Produk | Dimetil kuning |
| CAS | 60-11-7 |
| Formula molekul | C14H15N3 |
| Berat molekul | 225-29 |
| Detail Penyimpanan | Sekelilingnya |
| Kode Tarif Harmonisasi | 29270000 |
Spesifikasi produk
| Titik lebur | 105-116 Deg C |
| Penampilan | Kuning ke Oranye ke bubuk coklat |
| Pengujian kadar logam | 99% |
| Kerugian pada Pengeringan | <1,0% |
| Kekuatan | 98,67% |
| Perubahan Warna | Merah @ pH 2.9, Kuning @ pH 4.9 |
| Abu sulfat | 0,4% |
| Lamda Max | 400nm (dalam metanol) |
Topologi membran domain saluran colicin E1 dipelajari dengan transfer energi resonansi fluoresensi (FRET).FRET melibatkan asam amino fluoresen yang dikodekan secara genetik (coumarin) sebagai donor dan residu sistein berlabel selektif yang ditambatkan dengan DABMI (4- (dimethylamino) phenylazophenyl-4'-maleimide) sebagai akseptor FRET.Residu kumarin fluoresen dimasukkan ke dalam protein melalui pasangan sintetase tRNA / aminoasil-tRNA ortogonal yang memungkinkan penggabungan selektif ke situs mana pun dalam domain saluran colicin.Setiap varian memiliki mutasi stop (TAG) untuk penggabungan kumarin dan mutasi sistein (TGT) untuk lampiran DABMI.Enam jarak interhelikal dalam heliks 1-6 ditentukan menggunakan analisis FRET untuk keadaan larut dan terikat membran.Data FRET menunjukkan perubahan besar dalam jarak interhelikal di antara heliks 3-6 pada asosiasi membran yang memberikan wawasan baru ke dalam struktur yang terikat membran dari domain saluran.Secara umum, efisiensi interheliks coumarin-DABMI FRET menurun pada pengikatan membran, membangun model payung untuk saluran colicin.Model tentatif untuk keadaan tertutup dari domain saluran dikembangkan berdasarkan data FRET saat ini dan yang diterbitkan sebelumnya.Model ini menunjukkan susunan heliks 1-7 melingkar searah jarum jam dari sisi ekstraseluler dan hubungan antar muka membran heliks 1, 6, 7, dan 10 di sekitar jepit rambut transmembran pusat yang dibentuk oleh heliks 8 dan 9.



![3,3′,5,5′-Tetramethyl-[1,1'-biphenyl]-4,4′-diamine Cas:54827-17-7 99%](http://cdn.globalso.com/xdbiochems/54827-17-71.jpg)